Gel Shift Assay Using DS3000 Compact CE DNA Sequencer

株式会社日立ハイテク
アナリティカルソリューション事業統括本部
ライフ&メディカルシステム製品本部
バイオシステム第一設計部
隅田 周志

東北大学大学院 生命科学研究科
微生物遺伝進化分野
准教授
大坪 嘉行博士(農学)
DS3000 Compact CE Sequencer(DS3000)は高感度の蛍光シグナル検出器を備えたキャピラリ電気泳動装置である。現在、DNAシーケンサとして販売されている DS3000の電気泳動媒体(ポリマ)や泳動条件などを検討すれば、極めて多用途に利用可能なキャピラリ電気泳動装置として確立できる。特に DS3000は、ポリマがカートリッジに収められていて、容易に付け外しできるため、分析手法に合わせて容易にポリマを変更できる。さらに分析のたびにポリマを交換しても、廃棄されるポリマがほとんど発生しないという特長がある。この製品特長により、解析用途ごとに用いるポリマを交換して使用するという柔軟な運用が可能となる。DNA や RNA、あるいはタンパク質などを研究対象とする研究者にとって極めて有用な機器となることが期待される。ここでは装置の汎用性を示す一例として DS3000を用いたゲルシフトアッセイを紹介する。
ゲルシフトアッセイは、特定の塩基配列を持つ DNAと特定のタンパク質の結合を、電気泳動を用いて確認する手法である。DNA がタンパク質と結合して複合体を形成すると、サイズ変化や形状変化などによって電気泳動速度が低下する。本手法はこの原理を利用して結合を検出する手法であり、遺伝子発現や DNA 複製、組換えなど DNAと関連する様々なイベントに関わるタンパク質の結合配列の同定や、結合配列に生じた突然変異の影響を調べることができる重要な方法である。
DS3000を含む DNAシーケンサは、変性条件下で DNA を一本鎖にして電気泳動を行う。変性条件とするために、尿素などの変性剤を含むポリマを使用すること、泳動を60℃などの高温下で行うことが一般的である。一方、ゲルシフトアッセイでは DNAとタンパク質の結合を維持するために、非変性条件で電気泳動を行う。そのために変性剤を含まないポリマを選定し、泳動中の温度を40℃以下といった比較的低温に保つ必要がある。
本報告では、ポリマを POPTM Conformational Analysis Polymer(CAP、Thermo Fisher Scientific、4340379)を使用した。CAP は変性剤を含まないポリマである。さらに電気泳動時の温度を低温 (40℃ ) に設定した。DS3000ではキャピラリをオーブンで挟み込んで電気泳動時の温度を制御している。オーブン温度は DS3000の設定画面から変更できる。今回はオーブン温度を設定可能な最も低い温度(40℃)に設定した。
次に CAP の濃度を検討した。CAP の濃度が低すぎると二本鎖 DNA を分離できない。逆に濃度が高すぎるとキャピラリに充填できなくなる。CAP 濃度を検討した結果、CAP 9% の原液を電気泳動バッファで6% に希釈すると、二本鎖 DNA の分離とキャピラリへの充填を両立することができた(図1A)。
DNAとタンパク質の結合の解析は、細胞内の環境を考慮して10 ~ 150 mM 程度の塩が含まれる条件で実施する場合が多い。一方でサンプル溶液中に塩が含まれると、キャピラリへのサンプル注入効率が低下し、蛍光シグナルの強度が小さくなる(図1B、C)。これは、塩によりサンプル溶液の抵抗値が低下し、サンプル注入時に電圧がサンプル溶液部分に十分に印加されなくなったためと考えられている(参考文献1)。サンプル注入効率は、サンプル注入条件を変更することで改善できる。DS3000ではサンプル注入条件として注入電圧と注入時間を設定できる。注入電圧と注入時間はシグナルの強度に正に相関する。一方で、分解能とは負に相関する(参考文献2)。そのため、シグナル強度と分解能のバランスを考慮してサンプル注入条件を調整する必要がある。ここではサンプル注入電圧を1.6 kVと6.4 kV に設定してシグナル強度を比較した(図2)。注入電圧を6.4 kV にすると、150 mM の塩を含むサンプルであっても良好なシグナルの検出が可能であった。
蛍光シグナルの強度は、ポリマに塩を加えることでさらに大きくなる(図2C)。塩によりポリマの抵抗値が小さくなると、その分、サンプル溶液部分に印加される電圧が大きくなるためである。
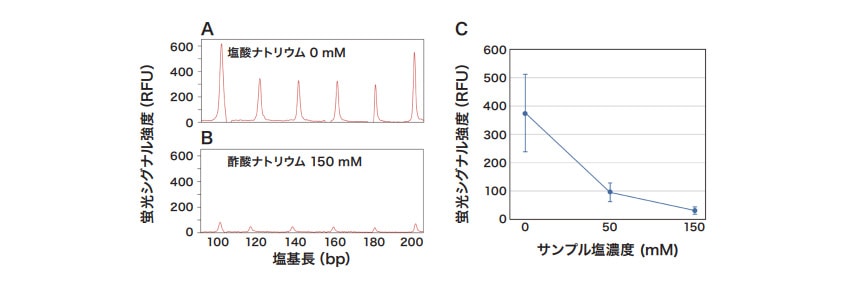
図1 キャピラリ電気泳動による二本鎖DNAの検出と塩濃度が信号強度に及ぼす影響
蛍光シグナル強度はGeneMarker v3.0.1(SoftGenetics)で算出されるピーク高さを示す。100-200 bpに相当する波形データの部分のみを示している。
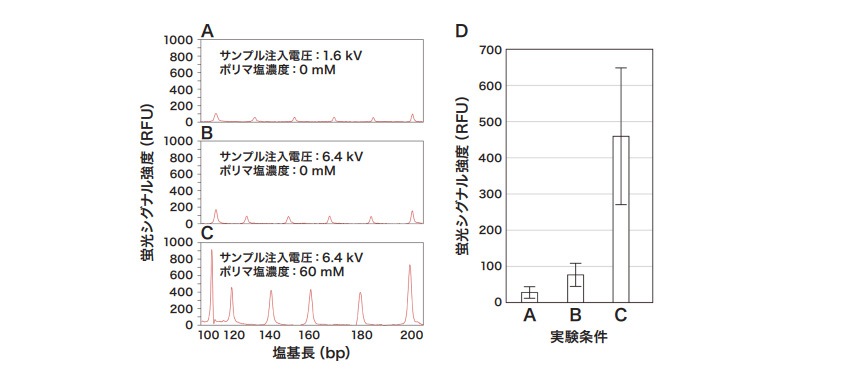
図2 塩を含むサンプルの注入効率
BphSタンパク質は、DNA配列特異的に結合する転写抑制因子である。BphSタンパク質と特定の DNA配列(pEプロモータ)の相互作用は詳細に検討されているため、優れたモデルシステムとなる(参考文献3)。図3に記載の条件で電気泳動を行ったところ、BphSタンパク質の濃度増加に伴って、2つのシフトピークが観察された。また、シフトピークは BphS 濃度が45 nM 以上のときに確認された。これらの結果はいずれも参考文献3の報告と一致した。以上から、DS3000を用いてBphSタンパク質とpEプロモータの結合を測定できることが示された。
本報告により、DS3000を用いてゲルシフトアッセイが可能であることが示された。ゲルシフトアッセイを DS3000で実施することには次のような利点がある。
ポリマには POP Conformational Analysis Polymer(濃度9%、Thermo Fisher Scientific、4340379)を購入し、ポリマ濃度が6% になるように、水と310 and 31xx Running Buffer, 10×(Thermo Fisher Scientific、402824)を添加して使用した (Running Buffer は終濃度1× )。電気泳動バッファには310 and 31xx Running Buffer(終濃度1×)を使用した。ゲルシフトアッセイに使用した DNA(pEプロモータ)と BphSタンパク質は、参考文献3に従って調製した。DNA-タンパク質複合体は0.1× PBS 中で0.1 nM の DNAと図3に示す濃度の BphSタンパク質で形成させた。サイズスタンダードには ILS600(Promega®、DG1071)を使用した。電気泳動は印加電圧13 kV、オーブン温度40℃で実施した。サンプル注入条件は図中に示した。図1、2のピーク波形図は GeneMarker v3.0.1(SoftGenetics)で得られる各フレームの数値データを元に描画した。蛍光シグナル強度は GeneMarker v3.0.1(SoftGenetics)で算出されるピーク高さとした。図3A、B の電気泳動図は TraceViwerForMolecularBiology(参考文献4)で描画した。
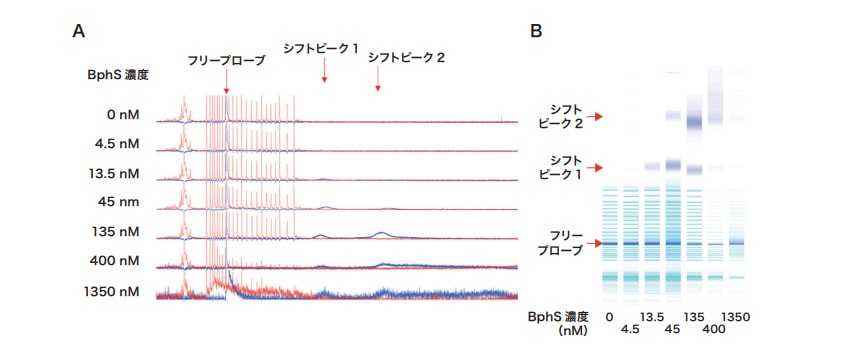
図3 BphSとDNA(pEプロモータ)の相互作用の解析
参考文献
本報告で用いられているゲルシフトアッセイは、DS3000 の標準の使用方法とは異なる方法で実施しております。方法の詳細をご希望の方 は別途ご連絡をお願い致します。